Ohne Bekämpfung der Varroamilbe stirbt ein Bienenvolk innerhalb von ein bis drei Jahren [1]. Die Honigbienen sind somit auf die Varroabekämpfung angewiesen. Doch welche Behandlung ist die beste? Wir haben für Sie die Vor- und Nachteile der gängigen Behandlungsmethoden zusammengestellt und geben einen Einblick in die aktuelle Forschung zu diesem Thema.
Chemische Methode
Die chemische Behandlung beruht auf einer erhöhten Toxizität bestimmter Substanzen für die Varroamilben im Vergleich zur Honigbiene. Da allerdings beide Arten zu den Gliedfüssern (Arthropoda) gehören ähneln sie sich in ihrem Stoffwechsel. Somit sind die verwendeten Substanzen auch für die Honigbiene giftig, allerdings ist die Wirkung aufgrund der grösseren Körpermasse geringer (höhere LD50)[2]. Grundsätzlich kann zwischen synthetischen und natürlichen Chemikalien unterschieden werden.
Synthetische Chemikalien
Die einzige in der Schweiz zugelassene synthetische Substanz zur Varroabekämpfung ist Coumaphos. Jedoch wurden in Norditalien bereits 1999 erste resistente Varroamilben entdeckt, es ist somit nur eine Frage der Zeit bis die Behandlung wirkungslos wird[3]. Zusätzlich wird Coumaphos im Bienenwachs eingelagert, wodurch der Wachskreislauf kontaminiert wird und die Substanz mit der Zeit auch für die Bienen schädliche Dosen erreichen kann4. Denn ab einem bestimmten Kontaminationswert im Wachs entstehen kleinere Königinnen, die eine erhöhte Wahrscheinlichkeit haben beim Hochzeitsflug nicht ausreichend begattet zu werden und somit keine Eier legen zu können[5-6]. Bei noch höheren Konzentrationen können sich überhaupt keine Königinnen mehr entwickeln [6]. Wir raten deswegen ausdrücklich davon ab, Coumaphos zur Varroabehandlung zu verwenden.
Natürliche Chemikalien
Zwar ist es grundsätzlich sicherlich besser natürliche Substanzen in die Umwelt einzutragen als synthetische, diese können allerdings ebenfalls schädlich sein für die Bienen. In der Schweiz werden für die Sommerbehandlung vor allem Thymol und Ameisensäure verwendet, für die Winterbehandlung meist Oxalsäure. Alle drei Chemikalien lösen eine Stressreaktion des Stoffwechsels der Bienen aus[7]. Für Oxalsäure wurde ausserdem nachgewiesen, dass sie sich im Verdauungstrakt der Bienen ablagert und dadurch Organschäden verursachen kann[8]. Alle drei Substanzen erhöhen die Mortalität der Bienen und verlangsamen die Volksentwicklung[9-15]. Beide organische Säuren (Ameisen- und Oxalsäure) können ausserdem Königinnenverluste herbeiführen [9,13].
Bereits 2004 wurde in Italien eine verminderte Wirksamkeit von Thymol gegenüber früheren Jahren gemessen[16], in der Schweiz konnte in diesem Jahr keine Reduktion des Varroabefalls mehr festgestellt werden nach Thymolbehandlungen[17]. Somit bietet Ameisensäure die effizientere Alternative zur Sommerbehandlung. Allerdings liegt die für die Honigbiene toxische Dosis nahe bei derjenigen der Varroamilbe und ist stark temperaturabhängig [2]. Deswegen ist es extrem schwierig in einer Umwelt mit schwankenden Temperaturen die Behandlung wirkungsvoll einzusetzen ohne die Bienen zu schädigen. Beide Sommerbehandlungen (Ameisensäure und Thymol) können ausserdem den Honig kontaminieren [18] und müssen deswegen nach der Honigernte angewandt werden – zu einem Zeitpunkt an dem die Varroapopulation bereits sehr stark angestiegen ist und die Bienen stark schädigt.
Hyperthermie
Hyperthermie beruht auf einer erhöhten Wärmetoleranz der Honigbiene im Vergleich zur Varroamilbe. Bei einer Wärmebehandlung von 42°C während einigen Stunden sterben die Varroamilben wohingegen die Bienen überleben[19]. Hyperthermie verfolgt einen biologischen Ansatz und kann während der ganzen Brutsaison angewandt werden, unabhängig von Honigernte und Wetter. Während die ersten Versuche einer konventionellen Anwendung von Hyperthermie nicht zum erhofften Erfolg führten, sind neuere Ansätze äusserst vielversprechend.
Wärmezufuhr von aussen
Erste Hyperthermie-Verfahren führten die Wärme von aussen zu und erwärmten den ganzen Stock. Als Reaktion darauf versuchten die Arbeiterinnen die Brut zu kühlen, wodurch die Temperatur schwer kontrollierbar war und die Arbeiterinnen unnötigem Stress ausgesetzt wurden. Solche Verfahren führten immer wieder zu Bienen- und Königinnenverlusten und zeigen nur eingeschränkte Wirkung gegen die Varroamilbe[20]. Um dem Kühl-Verhalten der Arbeiterinnen zu entgehen wurden bei neueren Verfahren sämtliche Brutwaben dem Volk entnommen und separat wärmebehandelt. Jedoch ist diese Methode mit einem grossen Zeitaufwand für den Imker verbunden und konnte sich deswegen nicht durchsetzen.
Wärmezufuhr von innen
Momentan sind neue Hyperthermie-Verfahren in Entwicklung, welche die Wärme durch einen im Wachs eingebautes Heizsystem erzeugen. Dadurch werden die Varroamilben dort bekämpft wo der Befall am stärksten ist – in der verdeckelten Brut. Gleichzeitig können die Bienen den Stock auf der üblichen Temperatur halten und werden keinem Stress ausgesetzt. Die Firma Vatorex testet zurzeit ein solches System in Zusammenarbeit mit dem Schweizerischen Zentrum für Bienenforschung. Erste Ergebnisse bestätigten die Wirksamkeit des Verfahrens, die Methode wird momentan in Hinblick auf Wirksamkeit und Bienenverträglichkeit optimiert.
Biomechanische Kontrolle
Die Varroamilben vermehren sich innerhalb von verdeckelten Brutzellen und zeigen eine starke Präferenz für Drohnen- gegenüber Arbeiterinnenbrut. Auf diesen Gegebenheiten beruhen die beiden biomechanischen Behandlungsmethoden Drohnenschnitt und Bannwabenverfahren.
Drohnenschnitt
Beim Drohnenschnitt werden im Frühling leere Rahmen eingesetzt, welche die Bienen als Drohnenwabe ausbauen. Anschliessend kann die Drohnenwabe ein- bis dreimal ausgeschnitten werden – jeweils wenn die Brut grösstenteils verdeckelt ist. Da die Varroamilben Drohnenbrut ca. 12mal häufiger parasitieren als Arbeiterinnenbrut, kann durch dieses Verfahren der Varroabefall im Frühjahr um bis zu 80% reduziert werden[21].
Allerdings stellt die wiederholte Entnahme von Drohnen einen starken Eingriff in die Populationsdynamik der Honigbiene dar. Denn obwohl die Drohnen ziemliche Faulpelze sind und für uns ImkerInnen somit von geringem Nutzen, sind sie dennoch Träger des genetischen Materials der nächsten Generationen von Jungköniginnen und Arbeiterinnen. Drohnen haben somit eine wichtige Funktion zur Erhaltung der genetischen Vielfalt, weswegen wir davon abraten die Drohnenwaben öfter als einmal pro Jahr zu entfernen.
Bannwabenverfahren
Beim Bannwabenverfahren wird die Königin auf eine Brutwabe abgesperrt, welche sobald die Brut verdeckelt ist entnommen und eingeschmolzen wird. Durch dreimalige aufeinanderfolgende Bannwaben-Entnahme können 80% der Milben entfernt werden[22].
Das Bannwabenverfahren empfiehlt sich bei erhöhtem Milbenbefall im Frühling und Frühsommer, da eine chemische Behandlung zu diesem Zeitpunkt Honigkontaminationen verursacht. Zusätzlich kann das Verfahren die erste Sommerbehandlung mit Ameisensäure ersetzen mit dem Vorteil, dass die Behandlung bereits während der Tracht begonnen werden kann (vorzugsweise Mitte Juli)[22-23]. Insgesamt zeigt die Behandlungsmethode eine hohe Wirksamkeit gegen die Varroamilbe ohne Kontaminationen zu verursachen, verlangsamt allerdings das Wachstum der Bienenvölker und ist sehr zeitaufwendig.
Zucht erhöhter Varroaresistenz
Diverse Merkmale der Honigbienen erhöhen deren Resistenz gegenüber der Varroamilbe und sind zu einem bestimmten Mass vererbbar. Dazu gehört die Fähigkeit der Arbeiterinnen sich gegenseitig die Milben vom Körper zu entfernen (Fellpflege-Verhalten) sowie die Fähigkeit infizierte Brut zu erkennen und auszuräumen (Hygiene-Verhalten)[24].
In Europa ist bisher keine resistente Zuchtlinie erhältlich, die Varroaresistenz kann allerdings von den ImkerInnen bei der Königinnenzucht als Zuchtmerkmal berücksichtigt werden. Zur Einschätzung der Resistenz können mehrere Messungen durchgeführt werden, die sich in Zeitaufwand und Genauigkeit unterscheiden. Am einfachsten ist die Messung des Milben-Populationswachstums über einige Monate. Allerdings ist das Populationswachstum von diversen Faktoren abhängig und somit ein eher ungenaues Zuchtmerkmal. Eine präzisere Messung der Resistenz ermöglicht ein Test auf Hygiene-Verhalten. Dazu werden verdeckelte Larven mit einer Nadel abgestochen und anschliessend erhoben wie gut die beschädigte Brut von den Arbeiterinnen entfernt wird[25]. Ausserdem ist der Anteil an beschädigten Milben auf der Unterlage ein gutes Mass für das Fellpflege-Verhalten, jedoch nur schwer zu ermitteln[25].
Grundsätzlich ist die Resistenz-Zucht zeitaufwändig und nur sehr langfristig (Jahrzehnte) erfolgsversprechend, da durch die natürliche Paarung die gewünschten Eigenschaften auch immer wieder verlorengehen können. ImkerInnen, welche mit der Resistenzzucht beginnen, werden somit nach wie vor auf Varroabehandlungen angewiesen sein, leisten aber einen Beitrag zu einer nachhaltigen Lösung für die Zukunft.
Aktuelle Forschung
Sexualpheromone
In einer laufenden Studie an der Universität Hohenheim, testen Forscher den Einsatz der weiblichen Sexualpheromone der Varroamilbe auf deren Fortpflanzungserfolg. Durch besprühen der Bienenwaben mit dem Pheromon konnten die männlichen Varroamilben verwirrt und in ihrem Sexualverhalten gestört werden. Die Männchen konnten nicht mehr unterscheiden zwischen bereits begatteten, noch nicht fortpflanzungsfähigen und empfänglichen Weibchen. Dadurch konnte die Fortpflanzungsrate der Milben um 20% reduziert werden[26].
Bücherskorpione
Weltweit leben mehrere Arten von Pseudoskorpionen natürlicherweise in Bienenstöcken. Die in Europa heimisch Art ist der Bücherskorpion (Chelifer cancroides), dessen Häufigkeit mit der modernen Imkerei allerdings stark abnahm. Denn die chemischen Varroa-Behandlungen sind auch für den Bücherskorpion tödlich. Ausserdem benötigen die Skorpione für das Überleben im Bienenstock ausreichend Schlupfwinkel, welche in modernen Beutesystemen nicht mehr vorhanden sind. Diese Abnahme ist bedauerlich, wiesen doch mehrere aktuelle Studien nach, dass sich Pseudoskorpione von Varroamilben ernähren können und bis zu 9 Milben pro Tag töten[27-30]. Das Ausmass mit dem die Bücherskorpione den Varroabefall eines Volkes reduzieren können ist bislang jedoch noch nicht untersucht worden und ihr Potential zur Varroabekämpfung somit noch ungewiss.
Pilze
Mehrere Forschungsgruppen untersuchen den Einsatz von entomopathogenen Pilze gegen die Varroamilbe. Diese Pilze können Gliedfüsser (Bienen und Varroamilben gehören zu dieser Gruppe) befallen und töten, wobei bisher noch keine Varroa-spezifischen Pilze bekannt sind. Die untersuchten Pilze bergen somit das Risiko auch die Bienen zu infizieren und schädigen. Bisherige Feldversuche erzielten wenig erfolgsversprechende Ergebnisse. Einerseits konnte teilweise eine nur geringe bis gar keine Wirkung gegen die Varroamilbe festgestellt werden[31-32], andererseits wiesen einige Studien eine Schädigung der Bienen nach. So kam es bei gewissen Behandlungen zu erhöhten Mortalitätsraten und zu einer Verminderung der Lernfähigkeit der Bienen[31,33].
Schlussfolgerung
Unterschiedliche Behandlungsmethoden weisen unterschiedliche Vor- und Nachteile auf. Bei der Beurteilung der Behandlungsmethoden müssen nicht nur die Wirksamkeit gegen die Varroamilbe berücksichtigt werden, sondern auch die Verträglichkeit für die Bienen und das Risiko auf Resistenzbildung der Milben. Zusätzlich können die Handhabung für den Imker und die mögliche Kontamination von Bienenprodukten entscheidende Faktoren sein (Tabelle 1).
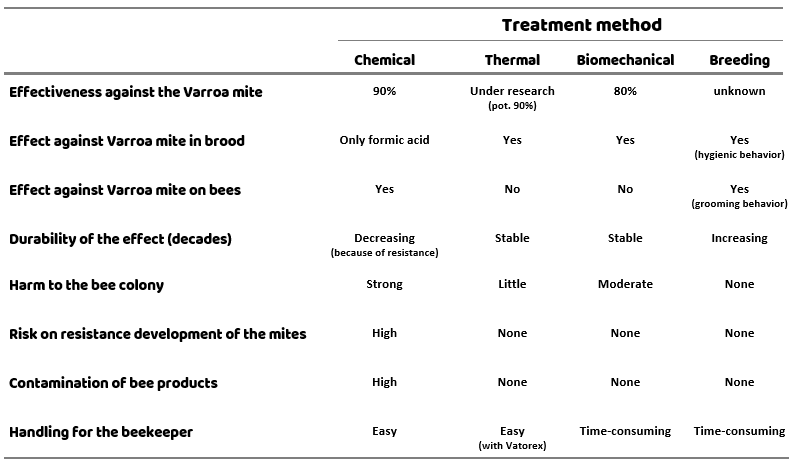
Zurzeit ist noch keine Behandlungsmethode verfügbar, die in allen Punkten optimale Ergebnisse erzielt – die beste Lösung besteht momentan wohl darin, unterschiedliche Behandlungen so zu kombinieren, dass die Vorteile maximiert und die Nachteile minimiert werden. Eine gute Strategie zu finden ist somit nach wie vor keine leichte Aufgabe!
Literatur
1 Fries, I., Imdorf, A. & Rosenkranz, P. Survival of mite infested (Varroa destructor) honey bee (Apis mellifera) colonies in a Nordic climate. Apidologie 37, 564-570, doi:10.1051/apido:2006031 (2006).
2 Underwood, R. M. & Currie, R. W. The effects of temperature and dose of formic acid on treatment efficacy against Varroa destructor (Acari : Varroidae), a parasite of Apis mellifera (Hymenoptera : Apidae). Experimental and Applied Acarology 29, 303-313, doi:10.1023/a:1025892906393 (2003).
3 Milani, N. The resistance of Varroa jacobsoni Oud. to acaricides. Apidologie 30, 229-234, doi:10.1051/apido:19990211 (1999).
4 Wallner, K. Varroacides and their residues in bee products. Apidologie 30, 235-248, doi:10.1051/apido:19990212 (1999).
5 Collins, A. M., Pettis, J. S., Wilbanks, R. & Feldlaufer, M. F. Performance of honey bee (Apis mellifera) queens reared in beeswax cells impregnated with coumaphos. Journal of Apicultural Research 43, 128-134 (2004).
6 Pettis, J. S., Collins, A. M., Wilbanks, R. & Feldlaufer, M. F. Effects of coumaphos on queen rearing in the honey bee, Apis mellifera. Apidologie 35, 605-610, doi:10.1051/apido:2004056 (2004).
7 Gunes, N. et al. Stress responses of honey bees to organic acid and essential oil treatments against varroa mites. Journal of Apicultural Research 56, doi:10.1080/00218839.2017.1291229 (2017).
8 Martin-Hernandez, R. et al. Short term negative effect of oxalic acid in Apis mellifera iberiensis. Spanish Journal of Agricultural Research 5, 474-480 (2007).
9 Higes, M., Meana, A., Suarez, M. & Llorente, J. Negative long-term effects on bee colonies treated with oxalic acid against Varroa jacobsoni Oud. Apidologie 30, 289-292, doi:10.1051/apido:19990404 (1999).
10 Rademacher, E. & Harz, M. Oxalic acid for the control of varroosis in honey bee colonies – a review. Apidologie 37, 98-120, doi:10.1051/apido:2005063 (2006).
11 Mert, G. & Yucel, B. Efficacy Levels of Organic Acids are Used for Controlling Varroa (Varroa jacobsoni Qudemans) and Their Effects on Colony Development of Honey Bees (Apis mellifera L.). Journal of Animal and Veterinary Advances 10, 1106-1111 (2011).
12 Ostermann, D. J. & Currie, R. W. Effect of formic acid formulations on honey bee (Hymenoptera : Apidae) colonies and influence of colony and ambient conditions on formic acid concentration in the hive. Journal of Economic Entomology 97, 1500-1508 (2004).
13 Giovenazzo, P. & Dubreuil, P. Evaluation of spring organic treatments against Varroa destructor (Acari: Varroidae) in honey bee Apis mellifera (Hymenoptera: Apidae) colonies in eastern Canada. Experimental and Applied Acarology 55, 65-76, doi:10.1007/s10493-011-9447-3 (2011).
14 Westcott, L. C. & Winston, M. L. Chemical acaricides in Apis mellifera (Hymenoptera : Apidae) colonies; do they cause nonlethal effects? Canadian Entomologist 131, 363-371 (1999).
15 Mattila, H. R., Otis, G. W., Daley, J. & Schulz, T. Trials of Apiguard, a thymol-based miticide Part 2. Non-target effects on honey bees. American Bee Journal 140, 68-70 (2000).
16 Floris, I., Satta, A., Cabras, P., Garau, V. L. & Angioni, A. Comparison between two thymol formulations in the control of Varroa destructor: Effectiveness, persistence, and residues. Journal of Economic Entomology 97, 187-191, doi:10.1603/0022-0493-97.2.187 (2004).
17 Robert Sieber, J.-D. C. Wieder etwas höhere Winterverluste. Schweizerische Bienenzeitung (2017).
18 Bogdanov, S., Charriere, J. D., Imdorf, A., Kilchenmann, V. & Fluri, P. Determination of residues in honey after treatments with formic and oxalic acid under field conditions. Apidologie 33, 399-409, doi:10.1051/apido:2002029 (2002).
19 Le Conte, Y., Arnold, G. & Desenfant, P. Influence of brood temperature and hygrometry variations on the development of the honey-bee ectorparasite Varroa jacobsoni (Mesostigmata, Varroidae). Environmental Entomology 19, 1780-1785 (1990).
20 Goras, G. et al. Hyperthermia -a non-chemical control strategy against varroa. Journal of the Hellenic Veterinary Medical Society 66, 249-256 (2015).
21 Calderone, N. W. Evaluation of drone brood removal for management of Varroa destructor (Acari : Varroidae) in colonies of Apis mellifera (Hymenoptera : Apidae) in the northeastern United States. Journal of Economic Entomology 98, 645-650 (2005).
22 Glanzmann, J. Bannwabenverfahren – eine säurefreie Varroabekämpfung. Schweizerische Bienenzeitung (2017).
23 Helen Albertin-Eicher, P. A.-E. Honig – Milben – Zuckerwasser. Schweizerische Bienenzeitung (2017).
24 Harbo, J. R. & Harris, J. W. Heritability in honey bees (Hymenoptera : Apidae) of characteristics associated with resistance to Varroa jacobsoni (Mesostigmata : Varroidae). Journal of Economic Entomology 92, 261-265 (1999).
25 Buchler, R., Berg, S. & Le Conte, Y. Breeding for resistance to Varroa destructor in Europe. Apidologie 41, 393-408, doi:10.1051/apido/2010011 (2010).
26 Ziegelmann, B. & Rosenkranz, P. Mating disruption of the honeybee mite Varroa destructor under laboratory and field conditions. Chemoecology 24, 137-144, doi:10.1007/s00049-014-0155-4 (2014).
27 Read, S., Howlett, B. G., Donovan, B. J., Nelson, W. R. & van Toor, R. F. Culturing chelifers (Pseudoscorpions) that consume Varroa mites. Journal of Applied Entomology 138, 260-266, doi:10.1111/jen.12096 (2014).
28 van Toor, R. F., Thompson, S. E., Gibson, D. M. & Smith, G. R. Ingestion of Varroa destructor by pseudoscorpions in honey bee hives confirmed by PCR analysis. Journal of Apicultural Research 54, 555-562, doi:10.1080/00218839.2016.1184845 (2015).
29 Donovan, B. J. & Paul, F. Pseudoscorpions: the forgotten beneficials inside beehives and their potential for management for control of varroa and other arthropod pests. Bee World 86, 83-87 (2005).
30 Fagan, L. L. et al. Varroa management in small bites. Journal of Applied Entomology 136, 473-475, doi:10.1111/j.1439-0418.2011.01666.x (2012).
31 Holt, M. Investigations into the suitabiity of entomopathogenic fungi and the identification of hyperparasitic fungi as antagonists of the honeybee mite Varroa destructor. Dissertation (2010).
32 James, R. R., Hayes, G. & Leland, J. E. Field trials on the microbial control of varroa with the fungus Metarhizium anisopliae. American Bee Journal 146, 968-972 (2006).
33 Kanga, L. H. B., Jones, W. A. & James, R. R. Field trials using the fungal pathogen, Metarhizium anisopliae (Deuteromycetes : Hyphomycetes) to control the Ectoparasitic mite, Varroa destructor (Acari : Varroidae) in honey bee, Apis mellifera (Hymenoptera : Apidae) colonies. Journal of Economic Entomology 96, 1091-1099, doi:10.1603/0022-0493-96.4.1091 (2003).